Truyền thông sức khỏe
Nhiễm khuẩn gram âm đa kháng thuốc
NHIỄM KHUẨN GRAM ÂM ĐA KHÁNG THUỐC
- 1. Giới thiệu
Kháng kháng sinh đang trở thành một trong những khủng hoảng y tế toàn cầu lớn nhất thế kỷ 21, gây ra khoảng 4,71 triệu ca tử vong năm 2021. Trong đó, vi khuẩn gram âm đa kháng thuốc là nguyên nhân chính.
Các yếu tố làm gia tăng tỷ lệ vi khuẩn gram âm đa kháng thuốc:
- - Lạm dụng và sử dụng kháng sinh không hợp lý ở người và trong chăn nuôi;
- - Thiếu nước sạch, vệ sinh và kiểm soát nhiễm khuẩn không đầy đủ;
- - Khả năng di truyền cao của vi khuẩn qua plasmid giúp lây lan gen kháng thuốc.
Hiện nay, tình hình kháng thuốc đang ngày càng trầm trọng, với nhiều chủng vi khuẩn gram âm đã kháng cả: carbapenem, polymyxin và các phối hợp β-lactam mới, Xu hướng này làm gia tăng nguy cơ xuất hiện các chủng vi khuẩn kháng toàn bộ thuốc, đặt ra thách thức lớn trong điều trị và kiểm soát nhiễm khuẩn.
Cơ chế đề kháng kháng sinh của vi khuẩn gram âm:
- - Biến đổi hoặc phá hủy kháng sinh. Ví dụ: enzym β-lactamase thủy phân kháng sinh nhóm β-lactam.
- - Giảm khả năng xâm nhập của kháng sinh vào tế bào, do mất porin trên màng ngoài.
- - Thay đổi vị trí tác động của kháng sinh. Ví dụ: biến đổi ribosome, khiến thuốc không còn nhận diện được mục tiêu.
- - Tăng cường bơm đẩy kháng sinh ra khỏi tế bào, thông qua bơm efflux xuyên màng hoạt động quá mức.
-
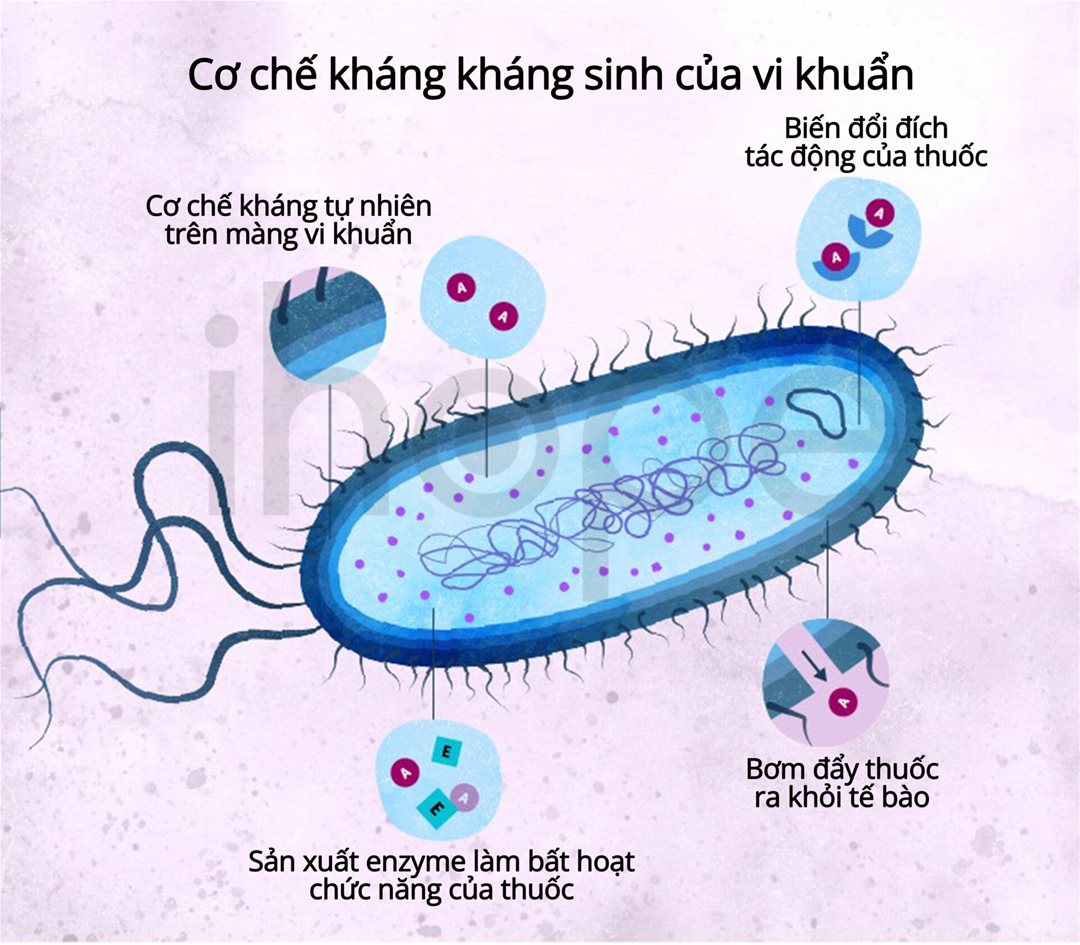
Hình 1. Cơ chế đề kháng kháng sinh của vi khuẩn
- 2. Một số vi khuẩn gram âm đa kháng thuốc
2.1 Enterobacterales (Vi khuẩn gram âm đường ruột)
Nhóm Enterobacterales gồm nhiều tác nhân gram âm phổ biến như Escherichia coli, Klebsiella spp., Proteus spp., Enterobacter spp. và Serratia marcescens. Các loài này thường cư trú ở đường ruột và có thể gây nhiễm trùng tiết niệu, ổ bụng và nhiễm khuẩn huyết, đặc biệt Enterobacter spp. và Serratia marcescens thường gặp trong môi trường bệnh viện.
Cơ chế kháng thuốc chính
ESBL (β-lactamase phổ mở rộng): là các enzym có serin tại vị trí hoạt động, phá vỡ vòng β-lactam. Các ESBL thường nằm trên plasmid di động, giúp lây lan nhanh giữa vi khuẩn. Enterobacterales sản xuất ESBL (ESBL-E) đã trở thành mầm bệnh lưu hành rộng rãi trên toàn cầu. Tỉ lệ ESBLs trong họ Enterobacterales thay đổi đáng kể tùy theo khu vực địa lý:
- - 5–25% ở Tây Âu, >50% ở Nam và Đông Âu;
- - 30% ở Mỹ Latinh, 11–13% ở Mỹ;
- - 30–80% ở châu Á, 10–15% ở Úc và New Zealand.
AmpC β-lactamase: xuất hiện ở Enterobacter spp., S. marcescens, Citrobacter freundii, Morganella morganii, Providencia spp. Các chủng vi khuẩn này kháng cephalosporin thế hệ 3, nhưng vẫn nhạy cảm với cefepim và carbapenem. Kháng acid clavulanic. Gen ampC thường nằm trên nhiễm sắc thể và có thể được kích hoạt khi tiếp xúc kháng sinh, gây kháng thuốc thứ phát.
Carbapenemase: Các enzym này thủy phân một loạt các kháng sinh β-lactam, bao gồm cả carbapenem, gây ra tình trạng kháng carbapenem.
Kháng carbapenem trong Enterobacterales cũng có thể do các cơ chế không phải carbapenemase như:
- Sản xuất quá mức ESBL,
- Mất porin,
- Tăng cường bơm tống thuốc (efflux pumps).
2.2 Pseudomonas aeruginosa
Pseudomonas aeruginosa là tác nhân gây nhiễm khuẩn bệnh viện phổ biến, có khả năng phát triển đa kháng thuốc nhanh chóng và phức tạp.
Cơ chế kháng thuốc
- Bơm tống thuốc như MexAB-OprM giúp vi khuẩn đẩy kháng sinh ra ngoài tế bào.
- Đột biến kênh porin làm giảm tính thấm màng tế bào, hạn chế kháng sinh xâm nhập.
- Cephalosporinase nội sinh.
Tình hình kháng thuốc
- Tỷ lệ kháng carbapenem của P. aeruginosa: khoảng 10–20%.
- Tỷ lệ đa kháng thuốc: khoảng 5–30%, tùy theo khu vực và loại nhiễm khuẩn.
2.3 Acinetobacter baumannii
Acinetobacter baumannii là một trong những vi khuẩn gram âm nguy hiểm nhất trong bệnh viện, tương tự Pseudomonas aeruginosa, với khả năng kháng thuốc cao.
Cơ chế kháng thuốc
- - Đột biến porin: giảm tính thấm của màng tế bào với kháng sinh.
- - Sản xuất nhiều loại enzym kháng thuốc, bao gồm: β-lactamase, enzym biến đổi aminoglycosid…
- - Bơm tống kháng sinh giúp loại bỏ thuốc ra khỏi tế bào.
Tình hình kháng thuốc
Tỷ lệ kháng carbapenem của A. baumannii vượt 30% trên toàn thế giới.
Một số khu vực có tỷ lệ rất cao:
- - Nam và Đông Âu: >50%.
- - Một số vùng châu Á: >80%.
- 3. Kháng sinh điều trị vi khuẩn gram âm đa kháng thuốc
Trong thập kỷ qua, nhiều kháng sinh mới được phát triển và đưa vào điều trị các nhiễm khuẩn gram âm đa kháng thuốc.
Việc lựa chọn kháng sinh cần dựa trên bốn yếu tố lâm sàng chính:
- - Vị trí nhiễm khuẩn (đường tiết niệu, phổi, máu…)
- - Mức độ nặng của nhiễm khuẩn
- - Tác nhân gây bệnh (Enterobacterales, Pseudomonas, Acinetobacter)
- - Cơ chế kháng thuốc liên quan (ESBL, AmpC, KPC…)
Kháng sinh cổ điển
- Trimethoprim-sulfamethoxazol, quinolon, nitrofurantoin: còn hiệu quả cho một số nhiễm khuẩn tiết niệu khi có bằng chứng nhạy cảm.
β-lactam vẫn là nhóm thuốc điều trị chính:
- - Carbapenem: được khuyến cáo cho nhiễm Enterobacterales kháng cephalosporin thế hệ 3.
- - Cefepim: có thể dùng cho Enterobacter spp. sản xuất AmpC, nếu mức độ kháng vừa phải.
- - Aminoglycosid: lựa chọn thay thế trong nhiễm khuẩn tiết niệu, nhưng hạn chế do độc tính thận và tai.
- - Nhóm tetracyclin: dùng phối hợp trong nhiễm A. baumannii hoặc Enterobacteral kháng carbapenem (CRE), nhưng không hiệu quả với Pseudomonas.
- - Fosfomycin: đường uống dùng trong viêm bàng quang do E. coli ESBL hoặc CRE.
- - Sulbactam (ampicillin–sulbactam): có tác dụng đặc biệt với A. baumannii, thường dùng liều cao kết hợp kháng sinh khác.
Kháng sinh mới cho vi khuẩn đa kháng thuốc:
- - Ceftolozan–tazobactam: hiệu quả cao với P. aeruginosa kháng carbapenem.
- - Ceftazidim–avibactam, meropenem–vaborbactam, imipenem–relebactam: lựa chọn hàng đầu cho CRE.
- - Cefepim–enmetazobactam: hoạt tính tốt với ESBL và AmpC.
- - Sulbactam–durlobactam: đặc trị A. baumannii kháng carbapenem, ít độc thận hơn colistin.
- - Cefiderocol: cephalosporin siderophore gắn với sắt, giúp xâm nhập tế bào qua kênh vận chuyển sắt. Hoạt tính cao: 97% với CRE, 97% với P. aeruginosa.
- - Eravacyclin: tetracyclin mới, hiệu quả với ESBL, CRE, ít bị ảnh hưởng bởi cơ chế kháng thông thường.
- 4. Các hướng tiếp cận điều trị không dùng kháng sinh cho vi khuẩn Gram âm đa kháng thuốc
4.1 Liệu pháp thực khuẩn thể (Phage Therapy)
Sử dụng virus tự nhiên (thực khuẩn thể, hay "phages") để tiêu diệt vi khuẩn. Liệu pháp này có tính đặc hiệu cao, không ảnh hưởng hệ vi sinh vật có lợi và không thúc đẩy kháng thuốc mới. Có thể tăng độ nhạy với kháng sinh khi dùng phối hợp → tạo hiệu ứng hiệp đồng.
Các thử nghiệm lâm sàng đang diễn ra: NCT05453578, NCT05498363, NCT04596319. Các peptid nguồn gốc từ phage như endolysin cũng được phát triển như protein tái tổ hợp để phá hủy thành tế bào vi khuẩn (đặc biệt A. baumannii).
4.2 Liệu pháp dựa trên hệ vi sinh
Ghép vi sinh vật đường ruột nhằm khử khuẩn đường ruột trước khi vi khuẩn kháng thuốc gây nhiễm thực sự. Tập trung vào ESBL-E và CRE.
Kết quả còn biến động; thử nghiệm ngẫu nhiên đầu tiên chưa chứng minh hiệu quả rõ rệt do cỡ mẫu nhỏ, nhưng nhiều nghiên cứu khác vẫn đang tiếp tục.
4.3 Liệu pháp kháng độc lực
Thay vì tiêu diệt vi khuẩn, liệu pháp này hướng đến ức chế các yếu tố độc lực của vi khuẩn, giảm khả năng gây bệnh.
Các hướng nghiên cứu gồm:
- - Ngăn vi khuẩn bám dính và hình thành biofilm;
- - Ức chế độc tố vi khuẩn;
- - Cản trở hệ thống tiết chuyên biệt;
- - Điều hòa biểu hiện gen độc lực.
Có tiềm năng lớn vì ít gây áp lực chọn lọc kháng thuốc, nhưng chưa có thử nghiệm lâm sàng quy mô lớn trên vi khuẩn gram âm.
Liệu pháp miễn dịch
Kích hoạt hoặc điều chỉnh phản ứng miễn dịch của cơ thể chống lại vi khuẩn:
- - Kháng thể đơn dòng nhắm vào yếu tố độc lực.
- - Kháng thể – thuốc liên hợp kết hợp tác động kép.
- - Vaccin: đang thử nghiệm cho E. coli, K. pneumoniae; trong khi P. aeruginosa và A. baumannii còn ở giai đoạn tiền lâm sàng.
- Liệu pháp điều hòa miễn dịch (checkpoint inhibitors, cytokin therapy, cell therapy) đang được phát triển.
4.5 Chất bổ trợ kháng sinh
Các hợp chất tăng hiệu quả kháng sinh bằng cách khắc phục cơ chế kháng:
- - Ức chế bơm efflux → ngăn vi khuẩn đẩy thuốc ra ngoài.
- - Chất tăng thấm màng → giúp thuốc thâm nhập qua lớp màng ngoài của gram âm.
Một số phân tử như NV716 vừa ức chế efflux, vừa tăng tính thấm, đang ở giai đoạn tiền lâm sàng.
TÀI LIỆU THAM KHẢO
Macesic N, Uhlemann AC, Peleg AY. Multidrug-resistant Gram-negative bacterial infections. Lancet. 2025 Jan 18;405(10474):257-272. doi: 10.1016/S0140-6736(24)02081-6. PMID: 39826970.
Tác giả
Ths. Kim Ngọc Sơn
Ths. Nguyễn Hiếu Minh

